重磅!MDA TEST发明人新作发表 | CAC在肺癌早诊研究的最新临床验证结果
重磅出击
非侵入式肺结节良恶性辅助诊断新技术
继在Clinical Cancer Research《临床肿瘤研究》杂志发表循环染色体异常细胞(genetically abnormal circulating cells, CAC)检测技术用于非小细胞肺癌诊断之后[1],近日,美国安德森癌症中心(MD Anderson Cancer Center)前细胞病理学科室主任、细胞图像诊断实验室主任,著名病理学专家Ruth L. Katz 教授在美国癌症协会(American Cancer Society)官方期刊Cancer Cytopathology 《癌症细胞病理学》,进一步揭示了CAC在肺部良、恶性结节患者外周血液中的分布差异,探索了基于4色荧光原位杂交(fluorescence in situ hybridization,FISH)的CAC检测应用于肺癌早诊、肺癌风险分层与诊疗决策的潜在价值[2]。

研究背景
1. 肺癌是世界范围发病率和死亡率最高的恶性肿瘤[3]。在中国,每年有超78万的肺癌新发患者,每5个恶性肿瘤死亡患者中就有一个是肺癌患者,发病率和死亡率在所有癌种中均位列第一[4]。
2. 早诊早治是提高肺癌患者存活率的关键[5]。I期肺癌患者在发现结节后一个月内接受手术切除和治疗,其10年存活率可高达92%[6]。因为缺乏有效的早筛早诊方法,只有10-15%的肺癌患者在早期被发现[3]。
3. 美国国家肺癌筛查试验(NLST)结果显示,与X线胸片相比,低剂量螺旋CT(LDCT)可降低20%肺癌死亡率[7]。LDCT被广泛推荐于高危人群肺癌筛查,但该研究同时发现LDCT假阳性率高达96.4%,临床为明确LDCT筛查出的肺结节性质,穿刺活检手术等有创性诊疗明显增加,而穿刺活检肺结节中有1/3左右为良性[8]。同时,穿刺手术可能对患者造成心理负担以及气胸、出血等创伤[9],使临床急需一种简便、安全、有效、无创的肺结节良恶性辅助诊断工具。
4. 研究发现循环肿瘤细胞(circulating tumor cells, CTC)可以比LDCT早1-4年发现恶性肿瘤[10]。但早期癌症患者外周血中的CTC含量稀少,目前CTC检测主要依靠细胞表面抗体(EpCAM等细胞表面蛋白)[11]。但大部分的血液中CTC都经历了上皮质间转换,从而失去了EpCAM表达,导致检测困难[11,12]。
5. 如果要将CTC用于肺癌早期诊断,必须突破其对上皮细胞标记物(EpCAM等)的依赖,同时将CTC与血液中白细胞区分开来[13]。Ruth L. Katz教授在肺鳞状细胞癌和腺癌中发现了多个共同缺失或扩增的基因,并在2010年Clinical Cancer Research杂志发表了利用FISH技术观测到3号染色体的3p22.1/3q29位点与10号染色体的10q22.3/CEP10位点在非小细胞癌患者基因组中变化的情况,开发了一种不依赖表面抗体检测非小细胞肺癌相关CTC的技术。她指出该技术可以成为肺癌辅助诊断工具,提高肺结节良恶性判断的准确率[1],并将这种新发现的CTC命名为循环染色体异常细胞(CAC)。
研究设计
研究实验组(n=107)中肺癌入组者均来自安德森癌症中心,并满足以下条件:
1)近期无其他脏器癌症史;
2)经过针芯穿刺活检、细针抽吸活检、手术切除等确诊肺癌患者。
研究对照组(n=100)由以下三部分组成:
1)来自某肺癌分子流行病学研究的26例受试者;
2)根据年龄、吸烟、癌症家族史划分为肺癌高危人群,并担心自己罹患肺癌(无癌症史)的受试者54例;
3)LDCT检测大于6毫米结节,穿刺活检病理学结果是良性结节的患者20例。
从2007年11月至2016年3月收集到的118例定义为开发集,随后本研究又收集到89例定义为测试集。

A)对无法确认良恶性的肺结节患者的血液进行Ficoll密度分离处理;
B)将外周血中的单个核细胞放置于玻璃载玻片上,并使用定制的4色荧光原位杂交法进行检测;
C)结果与针芯穿刺活检、细针抽吸活检、以及手术切除的组织结果进行比较。
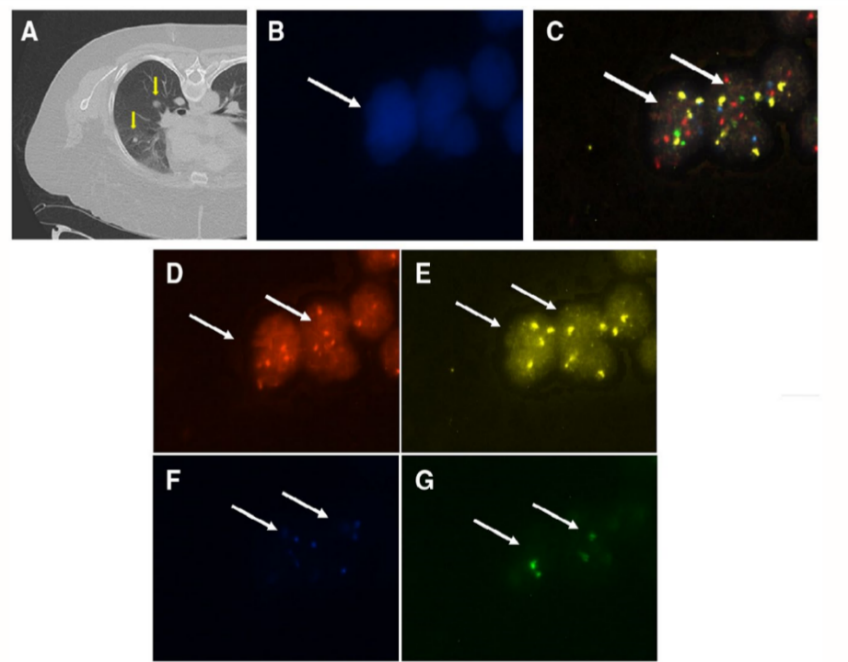
图2 典型阳性病例,显示LDCT扫描图像及对应FISH检测的结果:
A)一例55岁非吸烟女性患者的LDCT结果,发现多个未钙化的结节并疑似为真菌类疾病和恶性肿瘤;(B-G)在活检之前,通过FISH检测出8个CAC,图中显示了其中2个CAC的单独及融合荧光图像;
B)带有4ʹ,6-diamidino-2-phenylindole (DAPI) 染色的细胞核图像(原始放大倍数为100倍)。
C)CAC的合并图像显示3p22.1(红色)和10q22.3(金色)两个位点同时发生了扩增现象,CEP10(蓝色)和3q29(绿色)仍然为二倍体;染色体异常检测使用了4色FISH探针和BioView Duet-3显微镜系统(原始放大倍数400倍);
D)三个红色信号与3p22.1拷贝数一致(箭头处);
E)三个金色信号与3个10q22.3拷贝数一致(箭头处);
F)两个蓝色信号代表2个CEP10拷贝(箭头处);
G)两个绿色信号代表2个3q29拷贝(箭头处)。
研究结果

图3 受试者的详细统计资料
表1 循环肿瘤细胞在肺结节良恶性鉴别的辅助诊断效果
|
|
开发集 |
测试集 |
受试者整体 |
|
灵敏度 |
95.1% |
80% |
88.8% |
|
特异性 |
100% |
100% |
100% |
|
准确性 |
97.5% |
89.9% |
94.2% |
|
AUC |
0.9935 |
0.9970 |
0.9865 |

图4 ≥3个CAC作肺结节良恶性评估分层标准并与病理结果进行对比所得出的ROC曲线下方的面积大小(AUC):
A)开发集;B)测试集;C)受试者整体。
107例完成病理检测的肺癌受试者中,61%为腺癌,19%为鳞状细胞癌,其余的癌种占21%。早期肺癌患者占总数61%,I期患者55例,II期患者10例(图3)。
与病理结果对比分析后,CAC在肺结节良恶性的诊断效能非常理想,灵敏度在开发集和测试集中分别为95.1%和80%,特异性均为100%,整体准确率为94.2%(表1)。开发集、测试集以及受试者整体的ROC曲线下方的面积大小(AUC)分别为0.9935、0.9970和0.9865(图4)。
临床意义
本研究展示了一种简便、安全、有效、无创的检测手段,通过发现外周血细胞基因组中染色体异常,用于肺部结节良恶性辅助诊断。在107例确诊肺癌受试者中,61%(65例)为早期肺癌,验证了此技术能有效鉴别早期肺癌与良性结节。该技术还可以与肺癌风险评估工具(梅奥预测模型等)一起,更准确地评估肺结节良恶性风险程度,避免过度有创性诊疗。
这种新型液态活检技术,Ruth L. Katz教授在肺部组织[14]、痰液[15]和血液[16]样本中进行了研发与验证,此技术相较与基于抗体-抗原反应捕获CTC,优势在于不受CTC细胞表面抗原表达的限制,减少了肿瘤细胞上皮-间质转化的影响,对于缺乏细胞角蛋白表达的肿瘤细胞也可以进行检测,增加了外周血中肿瘤相关细胞的检出率。在细胞成像方面,通过BioView自动成像软件,自动分选细胞核大于一般淋巴细胞的染色体异常细胞,也有效提高了细胞捕获与鉴别效率。
如Ruth教授在文中提到,通过无创技术实现精准肺癌早期诊断,能为临床诊疗提供最有价值的技术支持[2]。斯坦福大学医学院资深病理学家Alarice Cheng-Yi Lowe教授发表专题评论文章指出[17],基于FISH的CTC检测方法可以作为传统组织病理检测的补充,还能用于其他非血液类样本分析,在无创技术和简单取样背景下探索新的精准诊断方式,是一个充满希望的细胞病理学研究领域。
参考文献
[2] KATZ R L, ZAIDI T M, PUJARA D等. Identification of Circulating Tumor Cells Using 4-Color Fluorescence In Situ Hybridization : Validation of a Noninvasive Aid for Ruling Out Lung Cancer in Patients With Low-Dose Computed Tomography – Detected Lung Nodules[J]. 2020: 1–10. . DOI:10.1002/cncy.22278.
[3] HOWLADER N, NOONE AM, KRAPCHO M等. SEER Cancer Statistics Review, 1975-2016.[R]//National Cancer Institute. .
[4] CAO M, CHEN W. Epidemiology of lung cancer in China[Z](2019). DOI:10.1111/1759-7714.12916.
[5] 中华医学会呼吸病学分会肺癌学组, 中国肺癌防治联盟专家组. 肺结节诊治中国专家共识(2018年版)[Z/OL](2018).
http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhjhhhx201810004. DOI:10.3760/cma.j.issn.1001-0939.2018.10.004.
[6] HENSCHKE C I, YANKELEVITZ D F, LIBBY D M等. Survival of patients with stage I lung cancer detected on CT screening[Z](2006). DOI:10.1056/NEJMoa060476.
[7] ABERLE D R, ADAMS A M, BERG C D等. Reduced Lung-Cancer Mortality with Low-Dose Computed Tomographic Screening[J/OL]. New England Journal of Medicine, 2011, 365(5): 395–409[2020–03–27]. http://www.nejm.org/doi/10.1056/NEJMoa1102873. DOI:10.1056/NEJMoa1102873.
[8] LOKHANDWALA T, BITTONI M A, DANN R A等. Costs of Diagnostic Assessment for Lung Cancer: A Medicare Claims Analysis[J]. Clinical Lung Cancer, 2017. DOI:10.1016/j.cllc.2016.07.006.
[9] HEERINK W J, DE BOCK G H, DE JONGE G J等. Complication rates of CT-guided transthoracic lung biopsy: meta-analysis[J]. European Radiology, 2017. DOI:10.1007/s00330-016-4357-8.
[10] ILIE M, HOFMAN V, LONG-MIRA E等. 《Sentinel》 circulating tumor cells allow early diagnosis of lung cancer in patients with Chronic obstructive pulmonary disease[J]. PLoS ONE, 2014. DOI:10.1371/journal.pone.0111597.
[11] DE WIT S, VAN DALUM G, LENFERINK A T M等. The detection of EpCAM+ and EpCAM- circulating tumor cells[J]. Scientific Reports, 2015. DOI:10.1038/srep12270.
[12] TRUINI A, ALAMA A, DAL-BELLO M G等. Clinical applications of circulating tumor cells in lung cancer patients by cellsearch system[Z](2014). DOI:10.3389/fonc.2014.00242.
[13] MOHAN S, CHEMI F, BRADY G. Challenges and unanswered questions for the next decade of circulating tumour cell research in lung cancer[Z](2017). DOI:10.21037/tlcr.2017.06.04.
[14] YENDAMURI S, VAPORCIYAN A A, ZAIDI T等. 3p22.1 and 10q22.3 deletions detected by Fluorescence in Situ Hybridization (FISH): A potential new tool for early detection of non-small cell lung cancer (NSCLC)[J]. Journal of Thoracic Oncology, 2008. DOI:10.1097/JTO.0b013e3181834f3a.
[15] KATZ R L, ZAIDI T M, FERNANDEZ R L等. Automated detection of genetic abnormalities combined with cytology in sputum is a sensitive predictor of lung cancer[J]. Modern Pathology, 2008, 21(8): 950–960. DOI:10.1038/modpathol.2008.71.
[16] NTOUROUPI T G, ASHRAF S Q, MCGREGOR S B等. Detection of circulating tumour cells in peripheral blood with an automated scanning fluorescence microscope[J]. British Journal of Cancer, 2008. DOI:10.1038/sj.bjc.6604545.
[17] ZHU Y, LOWE A C. Multiplexed Fluorescence In Situ Hybridization – Based Detection of Circulating Tumor Cells : A Novel Liquid-Based Technology to Facilitate Accurate and Early Identification of Non – Small Cell Lung Cancer Patients[J]. 2020. DOI:10.1002/cncy.22277.
